Beneficios de las Lentes Esclerales en Usuarios con Patologías Oculares
Por María Pérez-Angulo de Castro
Óptico-Optometrista y alumna del Máster en Optometría Clínica y Terapia Visual de SAERA
Tutora: Dra. Carmen Bilbao
RESUMEN
Las lentes esclerales han demostrado ser eficaces a la hora de proporcionar una buena calidad visual a pacientes con patologías de la superficie ocular, y en pacientes con ectasias corneales debido a que no tienen contacto con la córnea; sin embargo, también tienen algunos puntos en contra, ya que tiene un coste más elevado, requieren de profesionales especializados en su adaptación, y su manipulación es más complicada al principio en comparación con otras lentes de contacto.
Con el objetivo de evaluar la calidad de la evidencia científica, en esta revisión se seleccionaron 11 estudios sobre patologías oculares que se benefician del uso de lentes de contacto esclerales; dicha revisión se realizó mediante la herramienta QUADAS-2. El procedimiento constó de 4 fases: revisión de la pregunta, adaptación de la herramienta a esta revisión, diagrama de flujo del estudio primario y, por último, la valoración sobre los sesgos y aplicabilidad.
Tras el análisis, finalmente se concluyó que hay una carencia en la rigurosidad de la selección de pacientes, bien por falta de grupos de control, o bien por contar con muy pocos sujetos para la realización de los estudios; así como una carencia en la especificación de las fechas en las que se llevaron a cabo las pruebas o el seguimiento, pero también se extrajeron conclusiones positivas, y es que varios de estos estudios contaban con pruebas objetivas para el diagnóstico y la adaptación muy buenas, como la OCT. Por otro lado, también se comprobó en uno de los estudios que con poco material y tecnología también se pueden realizar buenos diagnósticos y adaptaciones de RPG y lentes esclerales en contextos de pobreza, lo cual puede ser crucial para facilitar a pacientes limitados por su calidad de visión y bajos recursos, el acceso a la educación y al trabajo.
Las lentes esclerales otorgan una buena calidad de visión en pacientes con diferentes afecciones visuales, no obstante, por su especificidad, hasta hace unos años las lentes esclerales eran adaptadas por muy pocos profesionales en el mundo, y, además, había pocos fabricantes que las ofrecían y a precios elevados. Hoy en día, gracias al auge de los cursos de formación especializados, al aumento de fabricantes que tienen las lentes esclerales en sus catálogos, a la optimización de los sistemas de producción y la mejora de los materiales disponibles, se realizan muchas más adaptaciones de lentes esclerales y los pacientes adaptados gozan de una mejor salud ocular y un mayor tiempo de uso que con las primeras lentes esclerales del mercado (Van Der Worp, 2010).
Las lentes esclerales
Las lentes de contacto esclerales son, en términos generales, lentes de contacto semirrígidas de un tamaño mayor que las lentes RPG (rígidas permeables a los gases) convencionales y que, por tanto, no se apoyan totalmente sobre la córnea, sino sobre la esclera, ya sea de forma total o parcial.
Las primeras lentes esclerales datan de hace más de 125 años y eran de vidrio soplado. Más tarde aparecieron las técnicas de moldeado para el vidrio en los años 30 del siglo XX, y en los años 40 surgió el material polimetil metacrilato (PMMA). Posteriormente surgió la técnica de torneado para la fabricación de las lentes, dando lugar a formas más precisas y adaptables a la forma del ojo. De los años 80 hasta la actualidad se han producido grandes avances tales como: materiales permeables al oxígeno, materiales más blandos, diseños de lentes más pequeños, diseños más personalizados como diseños tóricos, por cuadrantes para las córneas más irregulares o con óptica guiada por frente de onda (Van Der Worp, 2010).
- Clasificación de las lentes esclerales
Las lentes de contacto se han clasificado tradicionalmente en función de su tamaño, la zona de apoyo e incluso el reservorio de lágrima como se puede ver en la Tabla 1. No obstante, actualmente la Scleral Lens Education Society (SLS), recomienda una clasificación simplificada en la que desaparece la distinción entre los diferentes tamaños o zonas de apoyo y sencillamente define las lentes esclerales como aquellas que forman una bóveda sobre la córnea, con su correspondiente reservorio lagrimal y que descansan sobre la esclera (Michaud et al., 2020).
Tabla 1. Clasificación de las lentes esclerales en función de su tamaño, zona de apoyo y reservorio de lágrima
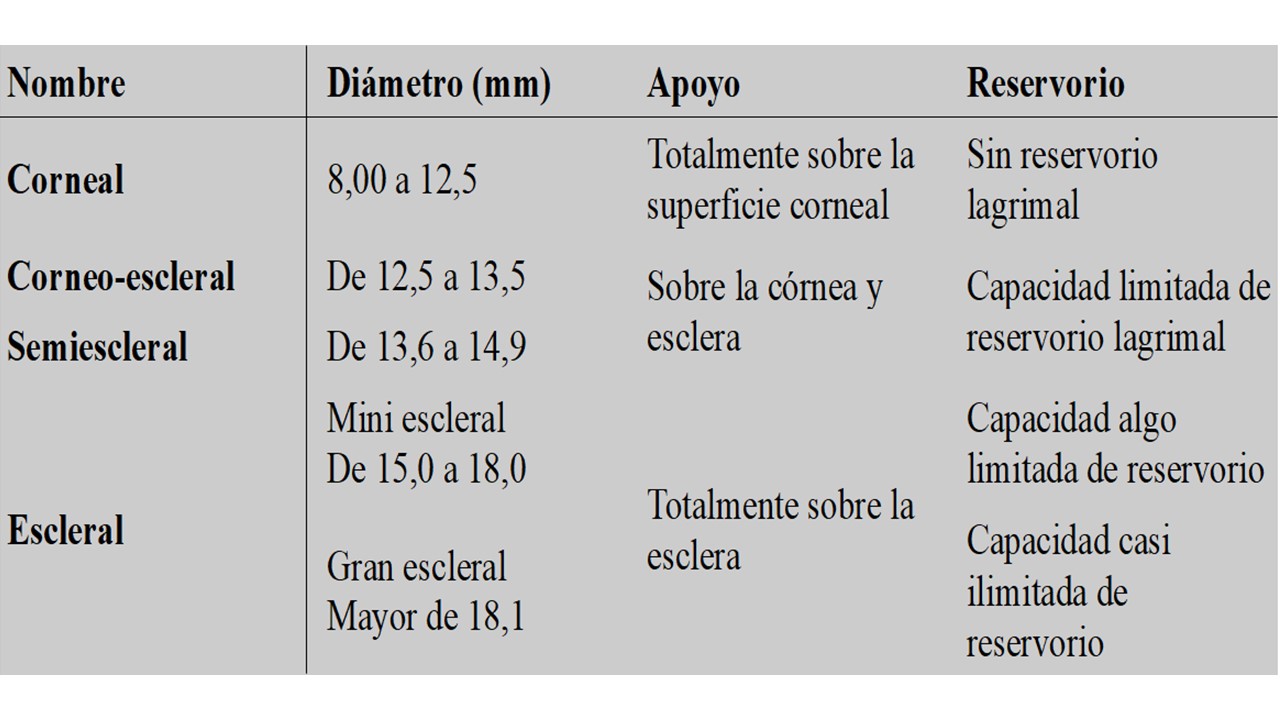
La tabla está inspirada en los datos recopilados de Jedlicka et al., (2010); Serramito Blanco, (2020); Sindt, (2008); Van Der Worp, (2010)
Además, por el perfil, los ojos que requieren estas adaptaciones, (ojos con ectasias, córneas irregulares o de difícil adaptación de otro tipo de lentes de contacto) a este tipo de lentes se las identifica más como prótesis y no como un producto cosmético alternativo a las gafas, matiz que puede ser importante especialmente de cara a las coberturas sanitarias, tanto públicas como privadas (Michaud et al., 2020).
- Diseño y forma de las lentes esclerales
Las lentes esclerales constan básicamente de tres partes que se pueden modificar a lo largo de la adaptación. Estas partes se pueden apreciar en la Figura 1 y son:
- La zona óptica.
- La zona de transición.
- La zona de apoyo.
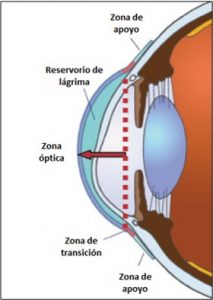
Figura 1. Partes de la lente escleral. Imagen editada y traducida a partir de la imagen del artículo de Koppen, C. (2016). Speciality Lenses for Keratoconus .https://crstodayeurope.com/articles/2016-jan/specialty-lenses-for-keratoconus/
La zona óptica es la zona central que produce la corrección óptica. Ésta puede ser esférica, asférica o tórica, pudiendo tener la superficie tórica tallada en la cara posterior, anterior o ambas (Serramito Blanco, 2020). El astigmatismo tallado en la cara externa va a ser empleado para corregir astigmatismos residuales, mientras que el astigmatismo tallado en la cara interna se va a usar principalmente para mejorar la estabilidad y minimizar las aberraciones de alto orden (Barnett, 2022). A diferencia de las lentes de gas permeables tradicionales, esta zona no va a tocar la superficie corneal. La zona óptica se describe por su radio de curvatura y su ancho (Michaud et al., 2020).
La zona de transición, también llamada zona limbal, es la zona que se encuentra uniendo la zona óptica con la zona de apoyo. Esta zona va a establecer la altura sagital de la lente y por tanto la cantidad de reservorio.
La zona de apoyo también es conocida como zona escleral, y es, como su propio nombre indica, la zona sobre la que va a descansar la lente en el ojo del paciente. Pueden presentar diseños tóricos o personalizados para un apoyo homogéneo sobre la superficie ocular (Serramito Blanco, 2020). Se recomienda que el área de apoyo tenga un mínimo de 3 mm de ancho para lograr una mayor comodidad de porte y que la presión pueda quedar distribuida de forma uniforme por toda la zona de apoyo (Van Der Worp, 2010).
Las lentes esclerales suelen ser más gruesas que las corneales, por lo que la relación Dk/t será menos eficaz. Por lo tanto, es importante que los materiales cuenten con un buen Dk. El aporte de oxígeno al ojo va a venir dado por esta capacidad del material para dejarlo pasar, y por el intercambio con los vasos conjuntivales y limbales, ya que la lente escleral va a cubrir de forma general el limbo esclerocorneal.
Una forma de favorecer la circulación de la lágrima es hacer fenestraciones o canales en la lente. Esta técnica se empleaba mucho con el material PMMA, sin embargo, hoy en día no hay consenso sobre si las fenestraciones influyen de forma positiva en el aporte de oxígeno a la córnea (Van Der Worp, 2010; Vincent & Bergmanson, 2022).
Las lentes esclerales tradicionales van a compensar las irregularidades y aberraciones que se inducen por deformidades de la cara anterior de la córnea. Sin embargo, en algunos casos de ectasias avanzadas esas irregularidades y deformaciones no sólo se producen en la cara anterior, sino también en la posterior, de forma que con las lentes tradicionales pueden estar presentes aberraciones de alto orden (HOA) que quedarían sin compensar. Para esos casos están indicadas las lentes de contacto esclerales con óptica guiada por frente de onda, que además de las condiciones del paciente, tiene en cuenta las rotaciones y descentramientos propias de la lente (Sabesan et al., 2013).
- Complicaciones de las lentes esclerales
Aunque las lentes esclerales son lentes muy seguras, éstas pueden presentar complicaciones de diversa índole. A continuación, se detallan brevemente las complicaciones más habituales (Van Der Worp, 2010):
- Manipulación: a menudo la manipulación e inserción de la lente puede suponer un problema en la adaptación debido a su gran tamaño.
- Burbujas de aire: pueden deberse a una mala colocación de la lente o a una mala adaptación. Estas burbujas pueden producir incomodidad o incluso mala visión.
- Enrojecimiento bulbar: puede producirse por reacciones alergias o una mala adaptación que produce estrés mecánico en la conjuntiva o hipoxia corneal.
- Tinción corneal: dependiendo de en qué cantidad, y dónde aparezca habrá que valorar una readaptación, si se trata de una reacción alérgica o si es independiente a las lentes y se debe a una enfermedad de la superficie ocular.
- Incomodidad: aunque suelen ser más cómodas que las lentes corneales, puede haber ciertos casos en los que no resulten cómodas. También tendrá un papel crucial el realizar una buena adaptación.
- Conjuntivitis Papilar Gigante: ésta tiene lugar por periodos prolongados de uso de lentes de contacto y acumulación de residuos en la superficie. No parece ser más frecuente en lentes esclerales que en lentes blandas.
- Hipoxia y edema: es fundamental controlar y vigilar el edema durante la adaptación y valorar el tipo de material y Dk que necesita el paciente. No solo hay que controlar el edema corneal, sino también el edema limbal, que suele ocurrir por compresión mecánica o adhesión de la lente.
- Adhesión de la lente: es poco habitual, pero si ocurre es fundamental su detección y readaptación de la lente.
- Queratitis microbiana e infiltrados: esta infección es poco frecuente con el uso de lentes RGP. Es importante para evitarla, realizar una buena manipulación y mantener una buena higiene y mantenimiento.
- Mucosidad y residuos: frecuentemente se depositan residuos en la lente de contacto. Estos residuos pueden afectar a la visión y además favorecer la aparición de conjuntivitis papilar gigante. Para prevenir esta complicación se recomienda hacer una limpieza correcta y exhaustiva de la lente una o dos veces al día.
- Neovascularización: puede ser causada por hipoxia, compresión mecánica, adhesión de la lente o tejido conjuntivo laxo.
Demografía y patologías que se benefician de su uso
Según las últimas estadísticas publicadas en la Gaceta de Optometría y Óptica Oftálmica, en España el 14% de las adaptaciones de lentes de contacto son de lentes permeables a los gases (excluyendo las de ortoqueratología), y dentro de ese porcentaje de lentes permeables, el 30% son adaptaciones de lentes esclerales (Santodomingo et al., 2022).
La mayoría de usuarios de lentes de contacto de cualquier tipo son mujeres (en torno al 60% a nivel mundial) (Santodomingo et al., 2021, 2022), jóvenes (entre 18 y 30 años), y el motivo de su uso suele ser más cosmético que sanitario (Amrizal, 2018; Ezinne et al., 2022); sin embargo, en las adaptaciones de lentes esclerales se encuentran unos perfiles algo distintos, ya que la mayoría de las adaptaciones las realizan hombres (más del 60%, frente a menos de un 40% de mujeres), y a personas mayores de la media de los otros tipos de lentes de contacto (Woods et al., 2020). Esto puede venir dado por la mayor incidencia de ectasias como el queratocono en hombres que en mujeres y a que este tipo de patologías están más avanzadas en personas de mediana edad que en jóvenes (Barnett et al., 2020; Nau et al., 2018).
Las lentes esclerales no suelen ser la primera opción de adaptación de lentes de contacto, normalmente se adaptan en casos que no mejoran lo suficiente o tienen contraindicados otros tipos de lentes de lentes de contacto. Los casos más habituales para su adaptación son los siguientes: (Barnett et al., 2020; Nau et al., 2018; Serramito Blanco, 2020; Van Der Worp, 2010):
- Ectasias y córneas irregulares; como son queratoconos, degeneraciones marginales pelúcidas, queratoglobos, queratoplastias o ectasias secundarias a la cirugía refractiva. Ésta es la principal indicación para la adaptación de lentes esclerales.
- Enfermedades de la superficie ocular. Ya que aportan protección a la superficie ocular a la vez que corrigen el posible error refractivo.
- Administración de fármacos.
- Traumatismos.
- Afaquia.
- Uso cosmético. Hay lentes esclerales pintadas a mano que se emplean para reducir destellos en la aniridia y el albinismo (Van Der Worp, 2012).
- Deportes.
Al ser lentes muy estables, éstas permiten diseños más elaborados y personalizados como descentramientos de la zona óptica o multifocalidades (Serramito Blanco, 2020).
En los estudios sometidos a revisión se han encontrado varios de estos potenciales usuarios, y sus patologías van a ser brevemente comentadas en los siguientes subapartados.
- Ectasias corneales
Las irregularidades corneales son el principal motivo de adaptación de lentes esclerales (Nau et al., 2018), y, dentro de esas irregularidades corneales, el queratocono es la que mayor incidencia presenta.
Queratocono
Es una patología corneal ectásica crónica que cursa con un incremento de la curvatura corneal y un adelgazamiento de la misma que puede ocasionar cambios refractivos, astigmatismos irregulares y mala calidad de visión. Suele ser bilateral y asimétrico.
Habitualmente aparece entre los veinte y treinta años de edad y se continúa desarrollando hasta los cuarenta años; después suele estabilizarse (Santodomingo-Rubido et al., 2022).
Las causas por las que aparecen los queratoconos son diversas y no están del todo claras. Sin embargo, se ha relacionado con factores genéticos, que unidos a algunos factores ambientales pueden desencadenar en el desarrollo de esta patología. Algunos de los factores ambientales son el uso de lentes de contacto, frotamiento ocular y alergias (Davidson et al., 2014).
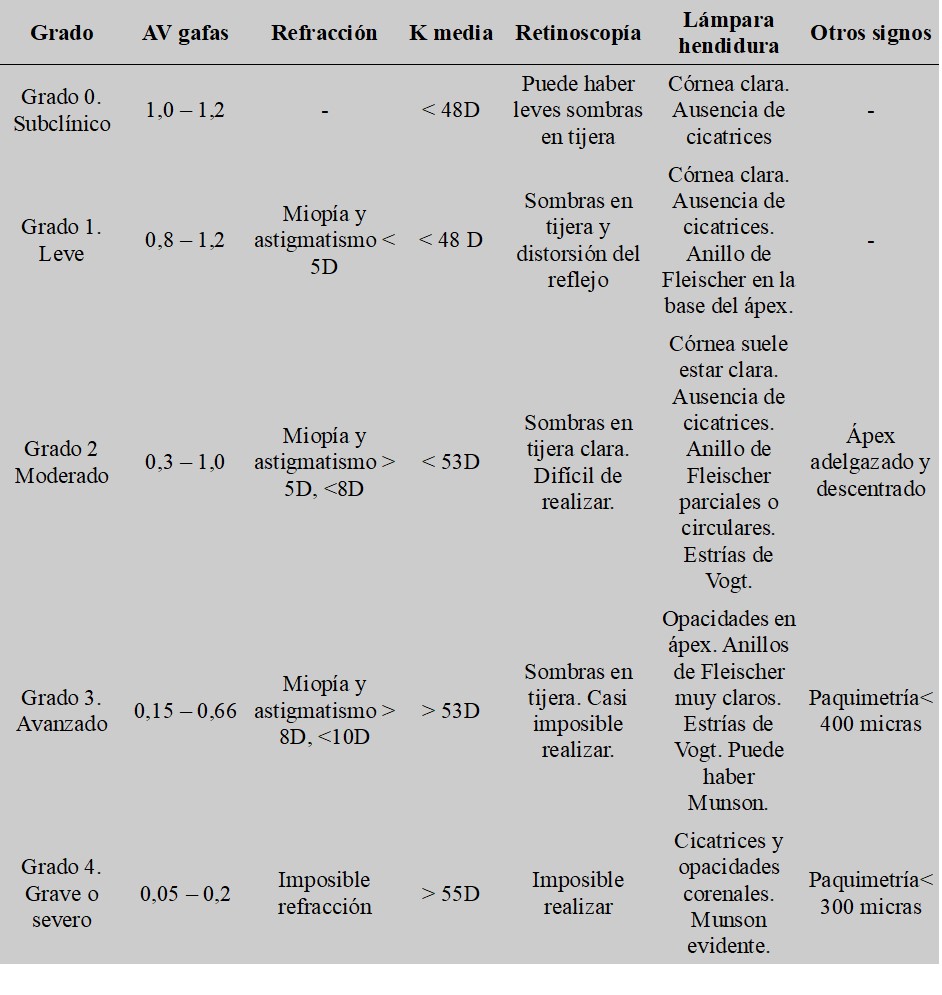
Los grados de severidad del queratocono han sido ampliamente descritos y hay diferentes escalas que relacionan el grado con la agudeza visual, los signos clínicos que se observan y hasta los cambios histológicos que se van produciendo en la progresión de la patología. Aquí se describen cinco grados basados en la clasificación de Amsler-Krumeich, y quedan recogidos en la Tabla 2.
Como se puede observar en dicha Tabla 2, según se produce el avance del queratocono, aumenta la curvatura, disminuye el grosor corneal en el ápex y, aparecen mayores astigmatismos irregulares y signos como cicatrices y opacidades.
Tabla 2. Grados del queratocono y sus signos (Giannaccare et al., 2021; Kanellopoulos & Asimellis, 2013; Masiwa & Moodley, 2020)
Degeneración marginal pelúcida (DPM)
Se trata de una degeneración ectásica que afecta a la zona inferior de la córnea y suele ser bilateral. Su sintomatología es AV reducida inducida por un astigmatismo irregular alto.
A menudo se puede confundir con un queratocono inferior, pero éste, a diferencia de la DMP, no presenta el adelgazamiento inferior en forma de banda. Además, la DPM no presenta los signos como anillos de Fleischer o estrías de Vogt. También a diferencia del queratocono, tiene una aparición más tardía. Es importante hacer un diagnóstico apropiado, ya que tanto el pronóstico como el tratamiento son diferentes (Mourelle, 2020).
Queratoglobo
El queratoglobo es una ectasia en la que se produce un adelgazamiento y protrusión de toda la córnea. En muchas ocasiones, el queratoglobo aparece también asociado a patologías de la superficie ocular, así como a frecuentes rupturas (hidrops) que tienen como resultado cicatrices y pérdida de la transparencia corneal (Rathi et al., 2015).
- Enfermedades de la superficie ocular
Aquí se encuentran agrupadas un conjunto de enfermedades que cursan con dolor, disminución de la AV que puede deberse a diversas causas tales como inflamación, queratinización o conjuntivación de la córnea y deficiencia de las células limbares (Moon et al., 2021).
Para estas enfermedades con síntomas crónicos, las lentes esclerales son beneficiosas ya que suponen un tratamiento alternativo y menos invasivo como es un trasplante de córnea.
A continuación, se mencionan y describen de forma somera algunas de las enfermedades de la superficie ocular encontradas en los estudios analizados.
Defectos epiteliales persistentes
Los defectos epiteliales persistentes (DEP), son lesiones corneales ulcerosas que no cicatrizan con facilidad con el tratamiento habitual como lubricantes y pomadas.
Los DEP tienen básicamente dos estrategias de tratamiento: la estrategia conservadora o el tratamiento quirúrgico. En la estrategia conservadora o no invasiva se sitúan, entre otras opciones, las lentes de contacto esclerales (Villaverde Piñeiro et al., 2022).
Enfermedad de injerto contra huésped
Tras la realización de un trasplante de células hematopoyéticas puede aparecer la enfermedad de injerto contra huésped (EICH). El principal tratamiento es la administración de medicamentos inmunosupresores. No obstante, la sintomatología ocular suele requerir además la administración de lubricantes oculares para disminuir la inflamación y mantener la integridad de la mucosa (Takahide et al., 2007).
La EJCH, además puede dar lugar a otras enfermedades de la superficie ocular (Takahide et al., 2007):
- Inflamación conjuntival aguda
- Conjuntivitis pseudomembranosa y cicatrizal
- Queratoconjuntivitis seca
Síndrome de Stevens-Johnson
Se trata de una enfermedad inmunológica grave en la que aparecen ampollas en la piel y en las mucosas que en su forma más agravada se denomina necrólisis epidérmica tóxica. Este síndrome es poco frecuente y cursa con una inflamación severa que puede afectar a varios órganos del cuerpo, entre ellos, los ojos (Liao et al., 2022).
Ojo seco
El síndrome de ojo seco se trata de una afección ocular común y multifactorial en la que la película lagrimal es inestable o deficiente. La sintomatología que presenta es dolor, inflamación, malestar ocular y visión borrosa (Tsubota et al., 2020).
Degeneración nodular de Salzmann
Esta patología no tiene una etiología clara, pero se piensa que se produce por un proceso degenerativo que es desencadenado por una inflamación crónica de la superficie ocular. En este proceso se produce una fibrosis subepitelial en la que se forman unos nódulos de color blanco azulado. Algunos de los síntomas que tienen los pacientes con esta afección son: erosiones recurrentes, fotofobia y epífora debida a la irritación de la superficie ocular (Chiu et al., 2014)
La herramienta QUADAS-2
La herramienta QUADAS (Quality Assessment of Diagnosis Accuracy Studies), fue desarrollada en un proyecto colaborativo entre Centre for Reviews and Dissemination, la Universidad de York y Academic Medical Centre de la Universidad de Amsterdam y publicada en 2003. Esta herramienta surgió para evaluar la calidad y exactitud de diferentes estudios de pruebas diagnósticas (aunque también es extrapolable a otras áreas), incluidos en una revisión sistemática mediante la combinación de la evidencia empírica y la opinión experta (Ciapponi, 2015; Whiting et al., 2003).
Gracias a la retroalimentación proporcionada por los usuarios, la herramienta fue mejorada y actualizada en 2010 en QUADAS-2, siendo actualmente una herramienta que estudia cuatro áreas clave: la selección de pacientes, la prueba en estudio, los estándares de referencia y el flujo de los pacientes y cronograma. En estas áreas se va a evaluar el riesgo de sesgo y la aplicabilidad.
La herramienta debe aplicarse en sus cuatro fases:
- Revisión de la pregunta
- Adaptación de la herramienta a la revisión en cuestión
- Revisión del diagrama de flujo del estudio primario
- Valoración sobre los sesgos y aplicabilidad
Dado que la herramienta debe ser adaptada a cada revisión, en ésta se han configurado las preguntas para los estudios seleccionados y se han recogido esas preguntas en las Tablas 3 y 4 del apartado de materiales y métodos.
Para que un área completa sea considerada de bajo riesgo, todas las preguntas deben serlo, si alguna resulta como incierta, toda el área se asume como de sesgo incierto y si aparece alguna pregunta con alto riesgo de sesgo, toda el área se asume con alto riesgo.
El objetivo de la presente revisión sistemática es conocer y analizar la evidencia científica sobre las patologías que se benefician del uso de las lentes esclerales, así como evaluar la rigurosidad mediante el riesgo de sesgo y la aplicabilidad de los estudios seleccionados mediante la herramienta QUADAS-2 adaptada a esta revisión.
También se van a tratar de conocer las carencias que pueden tener estos estudios tras el análisis con la herramienta, para así plantear otros posibles estudios en el futuro.
En este trabajo se ha realizado una revisión bibliográfica para analizar la calidad de diferentes estudios mediante la herramienta QUADAS-2. Esta herramienta permite analizar la validez tanto externa como interna gracias a sus cuatro fases y valoración sobre los sesgos y la aplicabilidad (Ciapponi, 2015; González Rodríguez & Velarde Mayol, 2012).
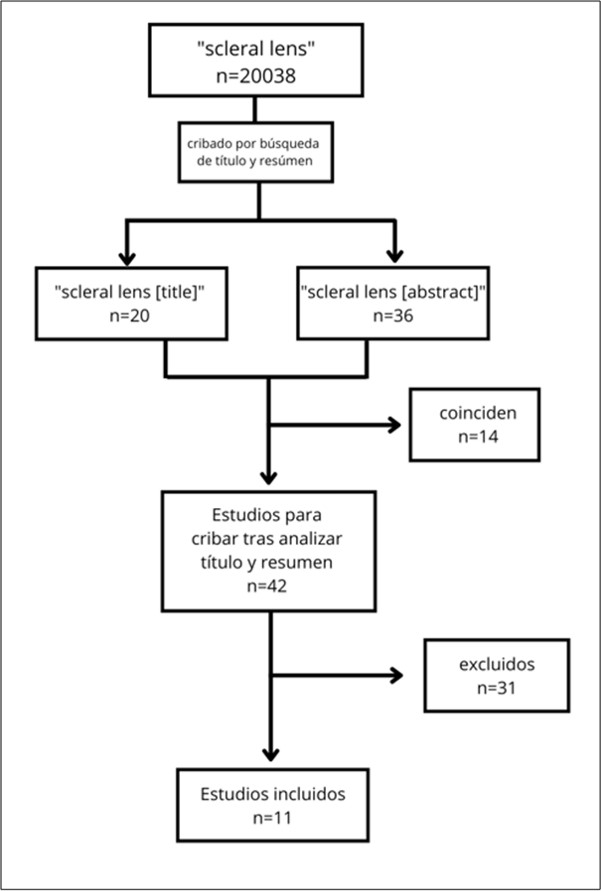
Para la selección de artículos se buscaron a 15 de septiembre de 2022 los artículos con las palabras clave “SCLERAL LENS”, obteniendo 20038 resultados. Para acotar más la búsqueda se filtraron esas palabras clave en título y abstract, obteniendo 20 y 36 respectivamente. De esos resultados se seleccionaron únicamente los estudios que trataran sobre patologías y condiciones que pudieran beneficiarse del uso de lentes esclerales. Tras esta selección se aplicaron los siguientes criterios de exclusión:
- Estudios en los que no se usaran las lentes esclerales en pacientes para mejorar una patología o condición; por ejemplo, estudios sobre lentes intraoculares, sobre el estudio de los tejidos oculares o medidas de presión intraocular con el porte de lentes intraoculares; así como estudios sobre tecnología y avances en lentes esclerales.
- Revisiones bibliográficas.
- Descripciones de casos (case report).
- Estudios basados en encuestas por email.
No se acotó por fecha de publicación. No obstante, cabe destacar que de los 11 artículos que finalmente fueron seleccionados, el 54,5% (6 artículos) han sido publicados en los últimos tres años (2019-2022), lo cual muestra del auge que está teniendo la adaptación de lentes de contacto esclerales, ya que el otro 45,5% de estos estudios (5 estudios) se publicaron hace entre 21 y 8 años (2001-2014).
La herramienta QUADAS-2 adaptada para el análisis de lentes esclerales se puede consultar en la Tabla 3 (para el análisis del sesgo) y en la Tabla 4 (para el análisis de la aplicabilidad). Las respuestas a las preguntas pueden ser “sí” (bajo riesgo, J), “incierto” (si no hay suficiente información para determinar el riesgo de sesgo, K) o “no” (alto riesgo, L).
El número de pacientes se ha establecido como bueno en este análisis como superior o igual a 20, e incierto entre 10 y 19 pacientes.
Tabla 3. QUADAS-2 sobre el sesgo adaptada (Ciapponi, 2015; Whiting et al., 2011)
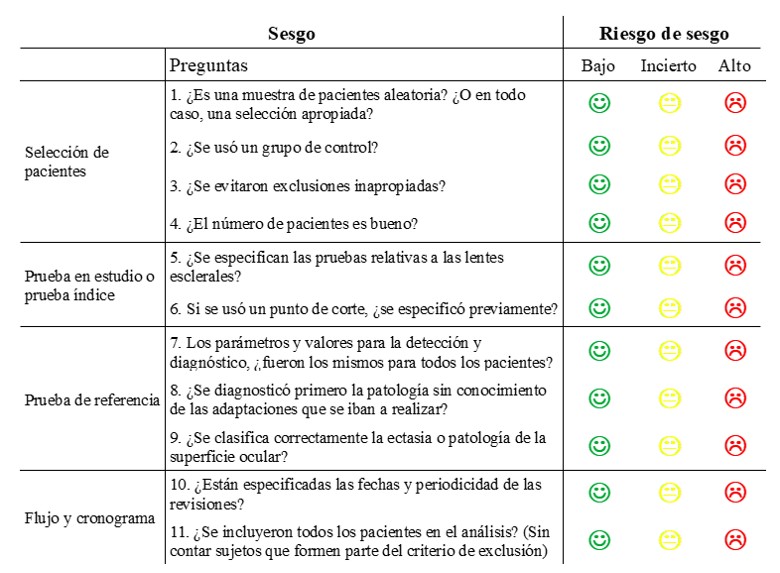
Tabla 4. Aplicabilidad de QUADAS-2 adaptada a la presente revisión (Ciapponi, 2015)
De la búsqueda realizada, se encontraron 42 artículos diferentes para someter a los criterios de inclusión y exclusión. Los artículos excluidos fueron 31. Los motivos de exclusión de estos estudios fueron los siguientes: no trataban sobre el uso de lentes esclerales para mejorar patologías oculares (22), eran meras descripciones de casos aislados (8) y otro era un estudio basado en una encuesta por email. En la Figura 2 se puede ver el diagrama de flujo de la selección de artículos.
Figura 2. Diagrama de flujo de la selección y exclusión de estudios
Los estudios que sí cumplieron los criterios de selección fueron 11; de éstos, 8 de ellos trataban sobre el uso de lentes esclerales en pacientes con ectasias corneales, tales como queratocono (la más habitual) y degeneración marginal pelúcida; los 3 estudios restantes empleaban las lentes esclerales en patologías de la superficie ocular, a destacar: defectos epiteliales, enfermedad de injerto contra huésped, síndrome de Stevens-Johnson, ojo seco, queratoconjuntivitis y degeneración nodular de Salzmann.
Hubo un estudio que no cumplió los criterios de selección, el estudio de Rathi et al. (2015), sin embargo, se ha querido mencionar en este apartado, ya que es el único estudio que trata sobre el queratoglobo; en él se describen y analizan todos los casos de queratoglobo en un centro de atención oftalmológica en la India (95 ojos en 48 pacientes). Este artículo fue descartado porque solamente se describen y analizan los casos de queratoglobo que hubo en dicha clínica, la diferente sintomatología y tratamiento que se empleó, donde se menciona que tan sólo a dos pacientes se les adaptaron lentes esclerales.
En cuanto a los 11 estudios seleccionados, se han recogido en la Tabla 5, donde se ha realizado un breve resumen, especificado los diferentes criterios de inclusión y exclusión, así como el número de pacientes que participaron, sus edades, el tipo de patología que presentaban y las lentes que se emplearon.
Tabla 5. Resumen, clasificación y características de los estudios en revisión

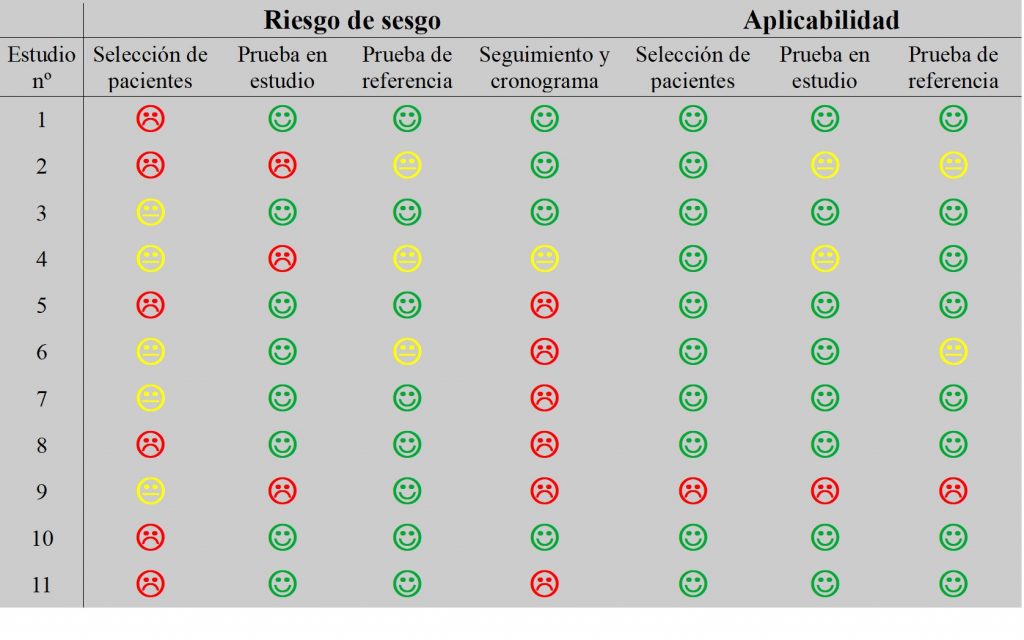
La calidad metodológica de cada estudio se evaluó mediante la herramienta Quadas-2 adaptada para esta revisión (Tablas 3 y 4) y los resultados se recogieron en la Tabla 6.
Ningún estudio quedó completamente exento de riesgo de sesgo en la selección de pacientes, no se incluyó grupo control en la mayoría, o las selecciones de pacientes eran demasiado pequeñas para ser representativas y garantizar un riesgo de sesgo bajo. En cuanto a la prueba en estudio, tan sólo hay tres estudios que presentan un alto riesgo de sesgo, ya que no se detallan. La prueba de referencia ha arrojado buenos valores, salvo en tres estudios que queda como incierta, pues no se especifican los parámetros para la detección y diagnóstico de la patología. En cinco de los once no especificaron la fecha o la periodicidad de las revisiones o adaptaciones y en uno no quedó claro si se incluyeron todos los pacientes. En cuanto a la aplicabilidad, los resultados son mucho mejores, tan sólo un estudio presentaba bajos resultados, dicho estudio no realizaba las pruebas en pacientes reales, sino con simulaciones por ordenador.
Tabla 5. Resultados del análisis con la herramienta QUADAS-2
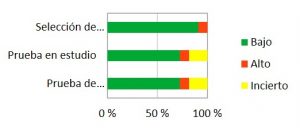
En las Figuras 3 y 4 se han agrupado los resultados globales de todo el análisis con la herramienta QUADAS-2. El rasgo más representativo del análisis realizado es la carencia de grupos de control o el bajo número de sujetos que presentan todos los estudios: en algunos estudios se presenta un buen número de pacientes, pero carecen de grupo de control; y en otros sí se comparan dos lentes en los mismos pacientes, pero éstos son muy pocos. Así como se aprecia en la Figura 3, el 54,5% presentan un alto riesgo de sesgo, y el 45,5% restante no queda especificado claramente. Otro factor que ha presentado un alto riesgo de sesgo en la mayoría de los estudios ha sido el flujo y cronograma, ya que muchos de ellos no han especificado la fecha de la realización de las pruebas y ahí se puede estar introduciendo un sesgo. El porcentaje de alto riesgo de sesgo en esta área es también de 54,5%, mientras que el 9% no se puede determinar y el 36,5% presenta un riesgo bajo.
Las pruebas en estudio y de referencia sí están bastante bien descritas en la mayoría de los estudios: un 72,7% presentan un riesgo de sesgo bajo, mientras que tan sólo el 27,3% presenta un riesgo de sesgo alto (para la prueba en estudio) o incierto (para la de referencia).
Figura 3. Gráfico sobre el riesgo de sesgo
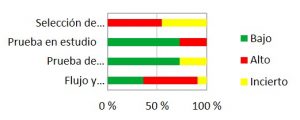
Figura 4. Gráfico sobre la aplicabilidad
En la presente revisión se han analizado estudios sobre diferentes tipos de patologías oculares que se ven beneficiadas del uso de lentes esclerales. Los estudios revisados se han realizado en diferentes años (un lapso de tiempo de 20 años, de 2001 a 2021) y en diferentes regiones a nivel mundial. Todas estas diferentes circunstancias hacen que sea conveniente matizar que los criterios de detección, adaptación y análisis son muy diversos.
En algunas ocasiones es complicado encontrar una muestra muy grande de una patología concreta a la que poder hacerle un estudio, como es el caso del artículo sobre la degeneración nodular de Salzmann (Chiu et al., 2014), en la que solamente se contó con 4 pacientes, quedando así una muestra poco representativa para extraer conclusiones fiables. En el propio estudio se menciona que es una de las limitaciones del estudio y que puede deberse a que los pacientes de esta patología suelen responder bien a la terapia convencional y no se ven obligados a recurrir a la adaptación de lentes esclerales salvo para los pacientes que no mejoran su sintomatología con dicha terapia.
La especificación clara de las fechas o el intervalo en el que se llevaron a cabo las pruebas sí es un aspecto que deberían incorporar todos los estudios, ya que es un dato sencillo de tomar. Seguramente en muchos de los casos no se tomó en cuenta al considerarlo poco importante pero, según el análisis con la herramienta QUADAS-2, aquí se puede estar introduciendo un sesgo por este motivo.
En cuanto a las pruebas, se han encontrado estudios que contaban con herramientas objetivas muy buenas como OCT (del inglés, Optical Coherence Tomography; tomografía de coherencia óptica), o el sensor de frente de onda de Shack-Hartmann.
A colación de la calidad de las pruebas diagnósticas y de adaptación, también es importante mencionar que en el estudio n.º 6 (Yego & Moodley, 2020), se mostró que, con pocos recursos y pruebas más básicas, se pueden obtener adaptaciones buenas que pueden ser cruciales en ambientes de pocos recursos, ya que gracias a estas adaptaciones se puede fomentar el desarrollo y el acceso a educación y trabajo de pacientes limitados por su calidad de visión y bajos recursos.
Prácticamente en todos los estudios analizados, los pacientes que se incluyen son los mismos que la población objetivo, el único que no lo cumple es el n.º 9 (Rijal et al., 2020), que basa sus cálculos en pacientes reales, pero después realiza simulaciones y basa sus conclusiones en ellas, indicando incluso en el propio estudio que sus cálculos teóricos podrían diferir de los reales al no considerar el movimiento dinámico de la lente en el ojo, o el efecto de la película lagrimal y su tiempo de rotura.
Una característica común de todos los estudios revisados es que los pacientes tienden a mejorar con el uso de lentes esclerales en todas las patologías (tanto las de la superficie ocular como las ectasias), sin embargo, hay que tener en cuenta que muchos de estos estudios carecen de grupo control, por lo que debería compararse el uso de las lentes esclerales con, por ejemplo, lentes corneales y analizar si una es mejor que otra, o bien si los resultados son similares. Hubo un estudio que sí comparaba adaptaciones de lentes esclerales con RPG (el estudio n.º 6 (Yego & Moodley, 2020)), sin embargo, se marcó como riesgo incierto porque las adaptaciones no eran a las mismas personas para comparar una respuesta u otra, y además se contaron con pocos casos de lentes esclerales en comparación con las corneales.
CONCLUSIONES
Como ya se ha mencionado anteriormente, así como en varios de los estudios analizados, y también se puede desprender del número de estudios de los últimos años, la adaptación de lentes de contacto esclerales está en auge, ya que son unas lentes de contacto permeables y muy seguras, sin contacto con la córnea, cuyas complicaciones, la mayoría, se pueden evitar con una adaptación correcta y una manipulación apropiada. Estas lentes dotan de buena calidad de visión a pacientes con córneas ectásicas y mejoran su calidad visual, así como también la sintomatología de pacientes con enfermedades de la superficie ocular.
Tras el análisis con la herramienta QUADAS-2, se mostró que faltan estudios que realicen pruebas con grupos control o con un número de pacientes adecuado. Este punto es fundamental, ya que la selección de pacientes guía en buena medida el resultado del estudio. La comprobación con un grupo control puede servir para comprobar si las lentes esclerales son realmente una opción superior o si con las lentes corneales o corneoesclerales se obtendrían los mismos resultados. Seguramente y debido a la cada vez mayor popularidad de este tipo de lentes de contacto, en un futuro se realicen estudios más completos.
El estudio sobre queratoglobo fue descartado por no cumplir los criterios de selección, no obstante, sería interesante también poder realizar en el futuro un estudio en el que se empleen diferentes sistemas de compensación en pacientes con queratoglobo y se comparen los resultados para hallar la mejor opción.
Los sujetos con patologías de la superficie ocular mostraron una mejoría general de sus síntomas con el porte de lentes esclerales, así como su AV; pero de nuevo, sería interesante haber comprobado con un grupo de control si esta mejoría se obtiene también con lentes RPG corneales.
Las lentes de contacto esclerales con óptica guiada por frente de onda son lentes que han mostrado disminuir las aberraciones de alto orden en ojos con queratoconos avanzados, altamente aberrados. Es por esto que debe considerarse como una opción para los pacientes más exigentes, ya que con esta personalización, pueden mejorar su AV entre 1 y 2 líneas. Por contra, este tipo de lentes personalizadas tiene un coste más elevado y requiere de un equipamiento tecnológico muy específico para poder medir las aberraciones, lo que hará que no sea siempre una opción viable.
Por último, concluir que, siempre que se pueda se tratarán de usar las mejores pruebas, pero es interesante ver cómo con poco material y, contando con buenos profesionales, se han podido realizar diagnósticos y buenas adaptaciones en ambientes de bajos recursos.
Akkaya Turhan, S., Özarslan Özcan, D., & Toker, E. (2020). Use of a Mini-Scleral Lens in Patients with Keratoconus. Turkish journal of ophthalmology, 50(6), 339–342. https://doi.org/10.4274/tjo.galenos.2020.56804
Amrizal, H. (2018). Contact Lens Wearer Demographics and Risk Behaviors for Contact Lens-Related Eye Infections. Contact lens, 1–3.
Barnett, M. (2022). The Importance of Embracing Modern Scleral Lens Terminology. Contact lens spectrum, June. https://www.clspectrum.com/newsletters/scleral-lens-monthly/june-2022
Barnett, M., Carrasquillo, K. G., & Schornack, M. M. (2020). Clinical Outcomes of Scleral Lens Fitting with a Data-driven, Quadrant-specific Design: Multicenter Review. Optometry and vision science: official publication of the American academy of optometry, 97(9), 761–765. https://doi.org/10.1097/OPX.0000000000001576
Chiu, G. B., Bach, D., Theophanous, C., & Heur, M. (2014). Prosthetic Replacement of the Ocular Surface Ecosystem (PROSE) scleral lens for Salzmann’s nodular degeneration. Saudi journal of ophthalmology, 28(3), 203–206. https://doi.org/10.1016/j.sjopt.2014.06.001
Ciapponi, A. (2015). QUADAS-2: instrumento para la evaluación de la calidad de estudios de precisión diagnóstica. Evidencia, 22–26. http://www.foroaps.org/files/64fe85009abba8c506e903adf90dbc17.pdf
Davidson, A. E., Hayes, S., Hardcastle, A. J., & Tuft, S. J. (2014). The pathogenesis of keratoconus. Eye, 28(2), 189–195. https://doi.org/10.1038/eye.2013.278
Ezinne, N. E., Bhattarai, D., Ekemiri, K. K., Harbajan, G. N., Crooks, A. C., Mashige, K. P., Ilechie, A. A., Zeried, F. M., & Osuagwu, U. L. (2022). Demographic profiles of contact lens wearers and their association with lens wear characteristics in Trinidad and Tobago: A retrospective study. PLoS ONE, 17(7 July), 1–11. https://doi.org/10.1371/journal.pone.0264659
Fuller, D. G., & Wang, Y. (2020). Safety and efficacy of scleral lenses for keratoconus. Optometry and Vision Science, 97(9), 741–748. https://doi.org/10.1097/OPX.0000000000001578
Giannaccare, G., Murano, G., Carnevali, A., Yu, A. C., Vaccaro, S., Scuteri, G., Maltese, L., & Scorcia, V. (2021). Comparison of amsler–krumeich and sandali classifications for staging eyes with keratoconus. Applied sciences (Switzerland), 11(9). https://doi.org/10.3390/app11094007
González Rodríguez, M., & Velarde Mayol, C. (2012). Fundamentos de medicina basada en la evidencia: Listas guía de comprobación de estudios sobre pruebas diagnósticas incluidos en las revisiones sistemáticas: declaración QUADAS. Evidencias En Pediatría, 8(20), 1–6. http://www.bris.ac.uk/qua
Hastings, G. D., Applegate, R. A., Nguyen, L. C., Kauffman, M. J., Hemmati, R. T., & Marsack, J. D. (2019). Comparison of Wavefront-guided and Best Conventional Scleral Lenses after Habituation in Eyes with Corneal Ectasia. Optometry and vision science, 96(4), 238–247. https://doi.org/10.1097/OPX.0000000000001365
Jedlicka, J., Johns, L. K., & Byrnes, S. P. (2010). Scleral Contact Lens Fitting Guide. Contact lens spectrum, October. https://www.clspectrum.com/issues/2010/october-2010/scleral-contact-lens-fitting-guide
Kanellopoulos, A. J., & Asimellis, G. (2013). Revisiting keratoconus diagnosis and progression classification based on evaluation of corneal asymmetry indices, derived from scheimpflug imaging in keratoconic and suspect cases. Clinical ophthalmology, 7(July), 1539–1548. https://doi.org/10.2147/OPTH.S44741
Koppen, C. (2016). Speciality Lenses for Keratoconus. CRST Europe. https://crstodayeurope.com/articles/2016-jan/specialty-lenses-for-keratoconus/
Liao, J., Asghari, B., & Carrasquillo, K. G. (2022). Regression of corneal opacity and neovascularization in Stevens-Johnson syndrome and Toxic Epidermal Necrolysis with the use of prosthetic replacement of the ocular surface ecosystem (PROSE) treatment. In American journal of ophthalmology case reports, 26, 101520). https://doi.org/10.1016/j.ajoc.2022.101520
Marsack, J. D., Ravikumar, A., Nguyen, C., Ticak, A., Koenig, D. E., Elswick, J. D., & Applegate, R. A. (2014). Wavefront-guided scleral lens correction in keratoconus. Optometry and vision science: official publication of the American academy of optometry, 91(10), 1221–1230. https://doi.org/10.1097/OPX.0000000000000275
Masiwa, L. E., & Moodley, V. (2020). A review of corneal imaging methods for the early diagnosis of pre-clinical Keratoconus. Journal of Optometry, 13(4), 269–275. https://doi.org/10.1016/j.optom.2019.11.001
Michaud, L., Lipson, M., Kramer, E., & Walker, M. (2020). The official guide to scleral lens terminology. Contact lens and anterior eye, 43(6), 529–534. https://doi.org/10.1016/j.clae.2019.09.006
Moon, J., Lee, S. M., Hyon, J. Y., Kim, M. K., Oh, J. Y., & Choi, H. J. (2021). Large diameter scleral lens benefits for Asians with intractable ocular surface diseases: a prospective, single-arm clinical trial. Scientific reports, 11(1), 1–11. https://doi.org/10.1038/s41598-021-82010-z
Mourelle, A. M. (2020). Degeneración marginal pelúcida: diagnóstico diferencial con queratocono. Blog Saera, Marzo. https://saera-campus.com/degeneracion-marginal-pelucida/
Nau, C. B., Harthan, J., Shorter, E., Barr, J., Nau, A., Chimato, N. T., Hodge, D. O., & Schornack, M. M. (2018). Demographic Characteristics and Prescribing Patterns of Scleral Lens Fitters: The SCOPE Study. Eye & contact lens, 44 Suppl 1, S265–S272. https://doi.org/10.1097/ICL.0000000000000399
Rathi, V. M., Murthy, S. I., Bagga, B., Taneja, M., Chaurasia, S., & Sangwan, V. S. (2015). Keratoglobus: An experience at a tertiary eye care center in India. Indian journal of ophthalmology, 63(3), 233–238. https://doi.org/10.4103/0301-4738.156927
Rijal, S., Hastings, G. D., Nguyen, L. C., Kauffman, M. J., Applegate, R. A., & Marsack, J. D. (2020). The Impact of Misaligned Wavefront-guided Correction in a Scleral Lens for the Highly Aberrated Eye. Optometry and vision science: official publication of the American academy of optometry, 97(9), 732–740. https://doi.org/10.1097/OPX.0000000000001577
Sabesan, R., Johns, L., Tomashevskaya, O., Jacobs, D. S., Rosenthal, P., & Yoon, G. (2013). Wavefront-guided scleral lens prosthetic device for keratoconus. Optometry and vision science, 90(4), 314–323. https://doi.org/10.1097/OPX.0b013e318288d19c
Santodomingo-Rubido, J., Carracedo, G., Suzaki, A., Villa-Collar, C., Vincent, S. J., & Wolffsohn, J. S. (2022). Keratoconus: An updated review. Contact lens and anterior eye, 45(3), 101559. https://doi.org/10.1016/j.clae.2021.101559
Santodomingo, J., Villa, C., & Morgan, P. (2021). Lentes de contacto adaptadas en España en 2020. Gaceta de optometría y óptica oftálmica, Enero 565.
Santodomingo, J., Villa, C., & Morgan, P. (2022). Lentes de contacto adaptadas en España en 2021: comparación con otros países. Gaceta de Optometría y Óptica Oftálmica, Febrero 57, 40–47.
Serramito Blanco, M. (2020). Estudio de los cambios en la superficie ocular por el uso de lentes de contacto esclerales. Universidad Complutense de Madrid.
Sherafat, H., White, J. E. S., Pullum, K. W., Adams, G. G. W., & Sloper, J. J. (2001). Anomalies of binocular function in patients with longstanding asymmetric keratoconus. British journal of ophthalmology, 85(9), 1057–1060. https://doi.org/10.1136/bjo.85.9.1057
Sindt, C. W. (2008). Basic Scleral Lens Fitting and Design. Contact lens spectrum, October. https://www.clspectrum.com/issues/2008/october-2008/basic-scleral-lens-fitting-and-design
Takahide, K., Parker, P. M., Wu, M., Hwang, W. Y. K., Carpenter, P. A., Moravec, C., Stehr, B., Martin, P. J., Rosenthal, P., Forman, S. J., & Flowers, M. E. D. (2007). Use of Fluid-Ventilated, Gas-Permeable Scleral Lens for Management of Severe Keratoconjunctivitis Sicca Secondary to Chronic Graft-versus-Host Disease. Biology of blood and marrow transplantation, 13(9), 1016–1021. https://doi.org/10.1016/j.bbmt.2007.05.006
Tsubota, K., Pflugfelder, S. C., Liu, Z., Baudouin, C., Kim, H. M., Messmer, E. M., Kruse, F., Liang, L., Carreno-Galeano, J. T., Rolando, M., Yokoi, N., Kinoshita, S., & Dana, R. (2020). Defining Dry Eye from a Clinical Perspective. International journal of molecular sciences, 21(23). https://doi.org/10.3390/ijms21239271
Van Der Worp, E. (2010). Guía para la adaptación de los lentes esclerales. Pacific University.
Van Der Worp, E. (2012). Beyond the corneal borders: An update on scleral lens fitting. Contact Lens Update, September.
Villaverde Piñeiro, L., Pin, C. A., & Otero Logilde, A. (2022). Revisión bibliográfica sobre la insulina tópica en el tratamiento de defectos epiteliales persistentes. 1–7.
Vincent, S. J., & Bergmanson, J. P. (2022). NO-FEE CE: Current controversies in scleral lens prescribing. Contact lens spectrum, August.
Whiting, P. F., Reitsma, J. B., Leeflang, M. M. G., Sterne, J. A. C., Bossuyt, P. M. M., Rutjes, A. W. S. S., Westwood, M. E., Mallet, S., Deeks, J. J., Reitsma, J. B., Leeflang, M. M. G., Sterne, J. A. C., & Bossuyt, P. M. M. (2011). QUADAS-2: A Revised Tool for the Quality Assessment of Diagnostic Accuracy Studies. Annals of internal medicine, 155(4), 529–536. https://doi.org/10.7326/0003-4819-155-8-201110180-00009
Whiting, P., Rutjes, A. W., Reitsma, J. B., Bossuyt, P. M., & Kleijnen1, and J. (2003). The development of QUADAS: a tool for the quality assessment of studies of diagnostic accuracy included in systematic reviews. BMC Medical research methodology, 721(2), 1919–1927. http://www.biomedcentral.com/1471-2288/3/25%0AReceived:
Woods, C. A., Efron, N., & Morgan, P. (2020). Are eye‐care practitioners fitting scleral contact lenses? Clinical and experimental optometry, 103(4), 449–453. https://doi.org/10.1111/cxo.13105
Yego, W. K., & Moodley, V. R. (2020). Visual acuity and refractive error improvement in keratoconic patients: A low-income context management perspective. Clinical optometry, 12, 113–122. https://doi.org/10.2147/OPTO.S258905
PUBLICACIONES RECIENTES EN OPTOMETRÍA
 VideoBlog: Lentes de Contacto para Queratocono
VideoBlog: Lentes de Contacto para QueratoconoEl queratocono es una enfermedad progresiva que causa adelgazamiento y deformidad de la córnea y que acaba produciendo inestabilidad refractiva debido a la aparición de…
Leer más » Estrabismos Inconcomitantes VS Estrabismos Concomitantes
Estrabismos Inconcomitantes VS Estrabismos ConcomitantesExisten muchas clasificaciones de los estrabismos, unas más completas y detalladas que otras, y la evidencia científica analizada mostró como los estrabismos incomitantes y comitantes…
Leer más » Ortoqueratología y Control de la Miopía
Ortoqueratología y Control de la MiopíaCada vez hay más gente que sufre miopía y la escasa información apenas recibida sobre esta ametropía hace que la población la considere como un…
Leer más »
FORMACIÓN RECOMENDADA
- 1 año
- On-line + prácticas presenciales
- Certificado por la Universidad Isabel I
- 8 meses
- 100% On-line
- Certificado por la Universidad Isabel I
- 8 meses
- 100% On-line
- Certificado por la Universidad Isabel I
LIBRO RECOMENDADO
Autor: Joaquín Vidal López
ISBN: 9788494476006
Páginas: 190
El Manual de Terapia Visual que presentamos es una guía ideal para todos aquellos especialistas de la Salud Visual que deseen conocer las distintas técnicas que pueden utilizar para tratar las disfunciones de la acomodación ocular, la binocularidad y la motilidad ocular en general desde una perspectiva multidisciplinar.
A lo largo de este Manual veremos qué entendemos por terapia visual, también llamada entrenamientos visuales u ortóptica, su evolución histórica, las características personales que pueden afectar al éxito de esta terapia y los conceptos fundamentales que hay que tener en cuenta al aplicar cualquier programa de terapia visual. También se describirán los aspectos fundamentales a tener en cuenta para desarrollar con éxito un programa de terapia visual y cómo debe ser la atención que proporcionemos a los pacientes que requieran de este servicio profesional.
Por último, se describirán los procedimientos de evaluación y tratamiento de la ambliopía, el estrabismo, las disfunciones oculomotoras, las disfunciones de la acomodación ocular y las disfunciones binoculares, poniendo en cada capítulo el foco de atención en los ejercicios que podremos llevar a cabo en cada caso y en las modificaciones que podremos introducir para aumentar o reducir el nivel de dificultad de las tareas.
Se trata de una obra de consulta fundamental para todos los ópticos, optometristas, médicos o especialistas de la salud visual en general que desean conocer en qué consisten estas técnicas, su fundamento teórico y especialmente, sus posibilidades de aplicación a la práctica profesional.